近日,
机械力信号在细胞通讯中扮演着至关重要的角色,它影响细胞的稳态维持、发育进程和病理变化。2021年诺贝尔生理
聂舟教授团队开发了一种从头设计的人工机械力受体(AMR),它是一种模块化的DNA-蛋白质嵌合平台,包含通用的机械感知和传递DNA(GMD)纳米器件。AMR能够将原本不具备机械力感应功能的细胞表面受体(如受体酪氨酸激酶,RTKs)重新编程,使其对特定力刺激产生响应。与传统的基因工程改造方法相比,AMR通过
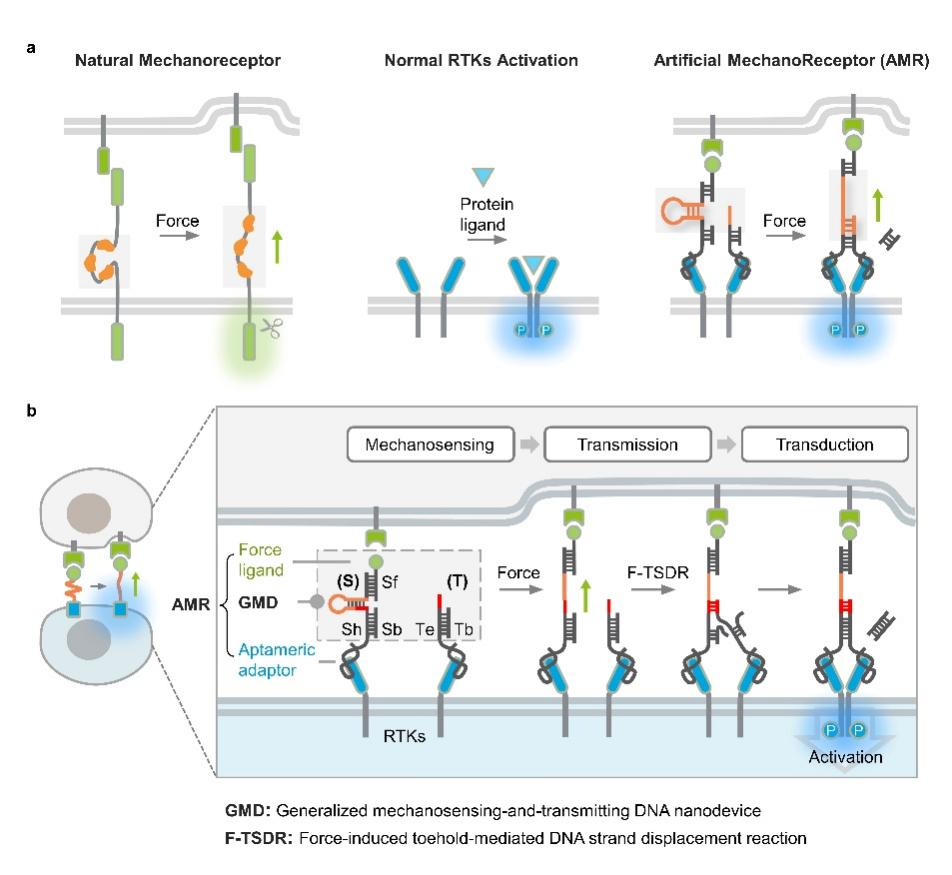
研究团队利用原子力显微镜、共聚焦激光扫描显微镜和dSTORM超分辨成像技术,展示了AMR在细胞膜上的力响应和信号激活性能。该研究发现通过对DNA序列进行简单编程,可以精确调控AMR的力响应阈值,实现在生理条件下皮牛(pN)范围内的精确控制。此外,AMR展现出优秀的通用性,能够灵敏地感知多种细胞产生的力,并调节不同的非机械响应性细胞表面受体。
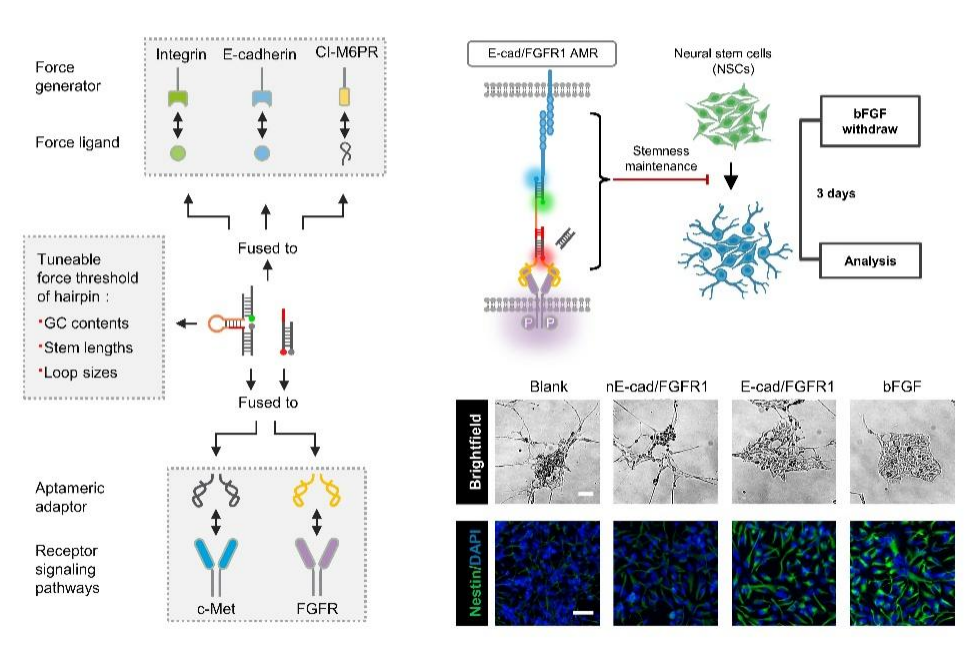
AMR的设计不仅在细胞力学信号系统重编程方面展现出巨大潜力,还在神经干细胞(NSCs)的干性维持中证明了其生物学功能。通过AMR介导的FGFR1信号通路重编程,在无需外源生长因子的情况下,仅通过细胞间的粘附力就可以维持NSCs的干细胞特性,为优化NSCs的体外培养及其临床应用提供了新思路。AMR策略为深入探索力学生物学原理以及在再生
相关研究成果以“DNA-functionalized Artificial Mechanoreceptor for de novo Force-responsive Signaling”为题发表在Nature Chemical Biology杂志上。

该工作得到了中国科学院力学研究所龙勉研究员和吕守芹研究员团队在原子力显微镜
来源:
责任
 高招云直播
高招云直播




